转自:一度医药
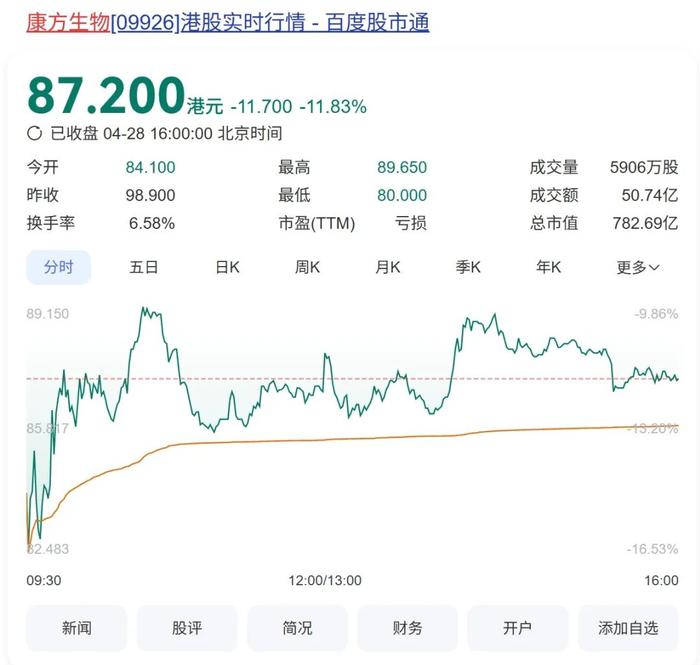
2025年4月28日,康方生物(9926.HK)股价开盘即跳水,单日跌幅接近12%,市值蒸发逾百亿港元。这场暴跌的导火索即是这几天引起业内广泛讨论的——其PD-1/VEGF双抗药物依沃西(Ivonescimab)与默沙东“药王”K药头对头试验的总生存期(OS)期对比结果的公布。
受此事影响,康方生物美国合作方Summit Therapeutics股价已暴跌37%......
HARMONi-2试验中OS数据引发担忧
康方生物公告显示,依沃西一线治疗PD-L1阳性NSCLC新适应症已获国家药监局批准上市,这也是依沃西获批上市的第二个适应症。此次获批是基于依沃西“头对头”帕博利珠单抗的随机、双盲、对照III期临床研究(AK112–303/HARMONi-2,CTR20222137,NCT05499390)中获得的显著阳性结果。
其中,这项HARMONi-2里关于OS数据的展示即这几天依沃西饱受业内争议的焦点。
HARMONi-2是一项用于评估依沃西单药与帕博利珠单药对比一线治疗PD-L1表达阳性(PD-L1 TPS≥1%)的局部晚期或转 移性NSCLC的注册性III期随机、双盲临床试验,共入组398例受试者。
结果显示,在ITT人群中,依沃西组和帕博利珠组的中位无进展生存期(PFS)分别为11.14个月和5.82个月,PFS HR=0.51 (P<0.0001),依沃西治疗组的疾病进展/死亡风险降低49%。
在ITT人群中,在39%成熟度时进行的总生存期(OS)的期中分析(本次分析α分配值仅为0.0001)结果显示,依沃西对比帕博利珠单抗具有显著的临床生存获益,HR=0.777,降低死亡风险22.3%。
这项实验的OS数据争议点有——患者死亡风险比(HR)为0.777(即风险降低22.3%),但未跨越预设的统计学显著性阈值α=0.0001。这一门槛远超肿瘤领域常规的α=0.05标准,相当于要求数据必须达到“万分之一的误差概率”,被花旗分析师称为“极高”标准。尽管HR值已显著低于临床意义阈值(通常认为HR
此外,K药在一线NSCLC的多数试验中OS风险降幅超30%,仅Keynote-042试验为19%。依沃西的22.3%虽优于后者,但未达市场期待的“颠覆性疗效”,尤其在双抗机制被寄予厚望的背景下,落差被放大。市场担忧若无法显著超越K药,如何撼动其295亿美元年销售额的“药王”地位?
不过,中国NMPA基于依沃西的PFS优势(中位PFS 11.14个月 vs K药5.82个月,风险降低49%)已快速批准其上市。
而Summit作为康方的海外合作方,掌握着依沃西的欧美日权益,其股价单日暴跌37%,不外乎外界对于该药在海外临床试验、审批等的进展关注。FDA对OS的要求严苛,目前披露的HARMONi-2的OS期中数据,让投资者担忧其全球III期试验(HARMONi-7)是否会重蹈覆辙。分析指出,若HARMONi-7需等到2026年才能获得最终OS数据,时间成本与不确定性将大幅侵蚀估值。这样的担忧不无道理。
康方拥有中国独家权益,可快速实现商业化(2024年双抗产品收入已超20亿元),而Summit的收益需依赖漫长且不确定的海外审批。这种“中国变现”与“海外赌注”的分割,导致资本从Summit撤出并转向康方,但康方今日的暴跌显示,市场对整体管线信心仍受冲击。
康方生物回应“OS期中数据”争议
值得关注的是,面对外界风云,康方创始人夏瑜在4月28日的沟通会作出回应。她指出,需要业内更关注HARMONi-2研究的申报目标,即以无进展生存期阳性结果在国内获得完全批准上市,并表示对HARMONi-2研究对应的海外临床HARMONi-7研究充满信心。实际上,在启动该注册III期研究前,公司已经与国家药监局药审中心(CDE)充分沟通,并达成一致,可以以无进展生存期数据获批。
2024年5月,该研究期中分析拿到了无进展生存期阳性结果,并获得监管认可。不过在后续审评中,药审中心进一步要求公司无论当时的试验成熟度(进度)如何,再提供一个总生存期指标上的初步分析,以观察依沃西单抗对患者的临床生存获益。
夏瑜强调,大家看待此次事件时,不能偏离问题本质,HARMONi-2研究的初衷是要在中国拿下该适应证,让患者受益,而目前这一点已经实现。从现有数据来看,公司对Summit在HARMONi-7研究上取得成功充满信心。
简单言之,其HARMONi-2的核心目标是基于PFS数据在中国获批,“统计学显著性并非设计初衷”。试验入组仅398例患者,样本量不足以支撑OS的统计效力,而海外HARMONi-7试验入组800例,设计更符合FDA要求,对成功充满信心。
康方事件凸显创新药研发中统计学严谨性与临床价值的冲突。若HARMONi-7能复现HR=0.777并达到统计显著,依沃西或可重塑治疗标准;反之,双抗赛道可能面临集体估值回调。
资料显示,HARMONi-7是依沃西单抗一项国际多中心III期临床试验。该试验旨在评估依沃西单抗单药治疗与默沙东的帕博利珠单抗(K药)单药治疗在PD-L1高表达的晚期非小细胞肺癌(NSCLC)患者中的疗效和安全性。
HARMONi-7试验计划招募约780名PD-L1高表达(TPS≥50%)的晚期NSCLC患者,样本量是之前在中国进行的HARMONi-2试验的两倍。这一设计优化旨在更贴近国际指南标准,同时提高统计学效力。
据悉,HARMONi-7试验已于2025年初启动,目前正在进行患者招募。该试验的顶线数据预计将在2025年中披露。
(转自:一度医药)

